La fabrication des cellules LiFePO4.
La batterie lithium-fer-phosphate (LiFePO4) est une technologie prometteuse pour les applications de stockage d’énergie grâce à sa sécurité inhérente, sa durabilité et son faible coût. Sa fabrication implique une série d’étapes complexes, de la synthèse des matériaux actifs des électrodes à l’assemblage minutieux des cellules en passant par la préparation de l’électrolyte. Un strict contrôle des procédés et de l’environnement de production est essentiel pour garantir des performances et une sécurité optimales de ces batteries.

- Préparation des matériaux :
- Le matériau actif de la cathode (LiFePO4) est généralement synthétisé par une réaction en phase solide à haute température (environ 700°C) entre un composé de lithium, un composé de fer et un composé de phosphate. Cette synthèse peut être réalisée par diverses méthodes comme la réaction à l’état solide, la co-précipitation, la synthèse hydro/solvothermale ou la synthèse par voie sol-gel.
- Le matériau actif de l’anode (graphite) est produit par un processus de graphitisation du coke de pétrole ou d’autres précurseurs carbonés à des températures supérieures à 2500°C.
- L’électrolyte est préparé en dissolvant des sels de lithium (généralement LiPF6) dans un mélange de solvants organiques tels que l’éthylène carbonate (EC), le diéthyle carbonate (DEC) et le diméthyle carbonate (DMC).
- Les séparateurs sont généralement constitués de fines membranes poreuses en polyoléfine (polypropylène ou polyéthylène) qui permettent le passage des ions lithium tout en isolant physiquement les électrodes.
- Assemblage des cellules :
- Les matériaux actifs des électrodes sont mélangés avec des liants polymériques (comme le PVDF ou la CMC), des additifs conducteurs (noir de carbone) et parfois des agents porogènes pour former une pâte homogène.
- Cette pâte est ensuite enduite (enduction) ou pressée sur des feuilles métalliques conductrices (généralement aluminium pour la cathode et cuivre pour l’anode) qui servent de collecteurs de courant.
- Après séchage, les électrodes sont découpées selon la taille requise.
- Les électrodes positive et négative sont empilées avec les séparateurs poreux entre elles, formant un assemblage électrode/séparateur/électrode.
- Cet assemblage est enroulé de manière compacte ou plié, selon la conception cylindrique ou prismatique de la cellule.
- L’ensemble est inséré dans un boîtier métallique ou un sac en alumine/plastique multicouche.
- L’électrolyte est ensuite injecté dans le boîtier, et la cellule est scellée sous atmosphère inerte (argon ou azote) pour éviter toute contamination par l’air ou l’humidité.
- Formation et test :
- Après assemblage, les cellules subissent un processus de formation qui consiste à charger et décharger lentement les batteries pendant plusieurs cycles. Cela permet d’activer les matériaux des électrodes et de former une couche de passivation protectrice à leur surface.
- Les cellules sont ensuite soumises à des tests électrochimiques (capacité, résistance interne, cyclage, etc.) et à des tests de sécurité (tests de surchauffe, de court-circuit, etc.) pour s’assurer qu’elles répondent aux normes de performance et de sécurité requises avant la commercialisation.
- Des contrôles qualité rigoureux sont effectués à chaque étape du processus de fabrication pour garantir la conformité et la reproductibilité des batteries produites.
Points supplémentaires importants :
- La propreté et le contrôle strict de l’environnement (salle blanche, atmosphère inerte) sont cruciaux pour éviter la contamination des matériaux et assurer des performances optimales.
- Des précautions de sécurité strictes doivent être prises lors de la manipulation des produits chimiques, notamment les solvants organiques et les électrolytes à base de lithium.
- Le choix des liants, des additifs et des procédés de mélange/enduction influence grandement les propriétés des électrodes et les performances électrochimiques de la batterie.
- Le processus de formation initial est essentiel pour conditionner les électrodes et permettre un fonctionnement optimal de la batterie lors de son utilisation.
Les batteries LiFePO4 sont idéales pour les systèmes de stockage d'énergie stationnaires
- Premièrement, elles offrent une excellente durabilité avec une capacité à supporter des milliers de cycles de charge-décharge, garantissant ainsi une longue durée de vie.
- De plus, leur stabilité chimique les rend plus sûres, minimisant les risques d’incendie ou d’explosion. Leur efficacité énergétique élevée assure une perte minimale d’énergie pendant le stockage et la libération, ce qui est essentiel pour maximiser l’utilisation de l’énergie renouvelable capturée.
- Enfin, elles sont respectueuses de l’environnement, ne contenant pas de métaux lourds toxiques et étant plus facilement recyclables, ce qui les rend préférables pour un avenir durable.
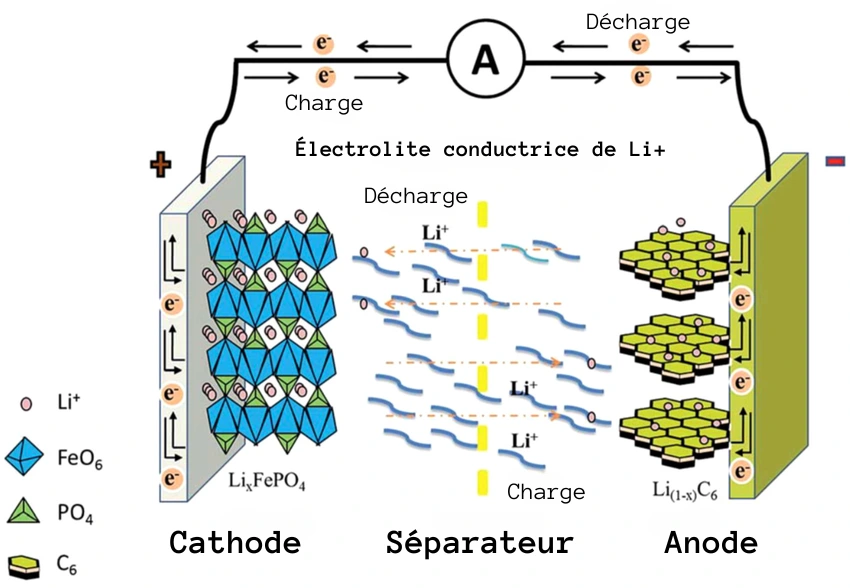
Principe de fonctionnement d'une cellule Lithium Fer Phosphate (LiFePO4 ou LFP)
Le principe de fonctionnement d’une batterie Lithium Fer Phosphate (LiFePO4 ou LFP) est similaire à celui des autres batteries lithium-ion, mais avec quelques différences au niveau des matériaux utilisés pour l’électrode positive et les réactions électrochimiques qui s’y produisent.
Une batterie LFP se compose de deux électrodes : une électrode positive (cathode) faite de lithium fer phosphate (LiFePO4) et une électrode négative (anode) généralement en graphite. Les deux électrodes sont séparées par un séparateur poreux imbibé d’un électrolyte, qui permet le passage des ions lithium (Li+) entre les électrodes.
Charge
Pendant la charge, les ions lithium se déplacent de l’électrode positive vers l’électrode négative à travers l’électrolyte et le séparateur. En même temps, un courant électrique externe circule dans le sens opposé, provoquant la réduction du lithium fer phosphate à l’électrode positive et *l’intercalation des ions lithium dans le graphite de l’électrode négative.
L’intercalation est un processus électrochimique réversible au cours duquel des ions, des atomes ou des molécules s’insèrent entre les couches d’une structure cristalline hôte, sans modifier significativement la structure de l’hôte lui-même. Dans le contexte des batteries lithium-ion, l’intercalation fait référence au processus par lequel les ions lithium (Li+) entrent et sortent des structures cristallines des électrodes pendant la charge et la décharge.
Pendant la charge d’une batterie lithium-ion, les ions lithium se déplacent de l’électrode positive (cathode) vers l’électrode négative (anode), où ils s’intercalent entre les couches du matériau d’électrode, généralement du graphite. Ce processus d’intercalation permet de stocker les ions lithium dans l’électrode négative, créant ainsi une réserve d’énergie.
Pendant la décharge, les ions lithium se déplacent de l’électrode négative vers l’électrode positive, où ils se désintercalent des couches du matériau d’électrode et réagissent avec celui-ci pour produire un courant électrique. Ce processus de désintercalation libère les ions lithium stockés dans l’électrode négative, permettant à la batterie de fournir de l’énergie à un appareil ou un véhicule connecté.
L’intercalation est un processus clé dans le fonctionnement des batteries lithium-ion, car elle permet le stockage et la libération réversibles des ions lithium, ce qui confère à ces batteries une haute densité énergétique, une longue durée de vie et une excellente efficacité énergétique.
Décharge
Pendant la décharge, le processus s’inverse. Les ions lithium se déplacent de l’électrode négative vers l’électrode positive, traversant l’électrolyte et le séparateur. Cette migration des ions lithium entraîne la libération d’électrons dans l’électrode négative, qui circulent dans un circuit externe pour fournir de l’énergie à la charge connectée (par exemple, un appareil électronique ou un moteur électrique). À l’électrode positive, les ions lithium réagissent avec le lithium fer phosphate pour former du phosphate de fer (FePO4) et libérer des électrons, qui rejoignent le circuit externe.